Sonderforschungsbereich 958 "Einrüstung von Membranen - Molekulare Mechanismen und zelluläre Funktionen"
***Achtung: die deutsche Seite wird nicht mehr unterstützt - für weitere Informationen bitte die englische Version anwählen***
Der räumlich und zeitlich kontrollierte Aufbau von Proteingerüsten an Membranen spielt eine entscheidende Rolle für Prozesse des Membrantransports und der Membranremodellierung, für zelluläre Signalwege und für Zelldifferenzierung und -entwicklung. Der Sonderforschungsbereich zielt darauf ab, die molekularen Mechanismen aufzuklären, die es dynamisch organisierten Proteinkomplexen erlauben Membranen einzurüsten und zelluläre Funktionen zu steuern.
Membranassoziierte Proteingerüste können als metastabile Strukturen angesehen werden, die eine Aviditäts-kontrollierte Multikomponenten-Matrix ausbilden. Wie sich die Gerüstfunktion aus der dynamischen Wechselwirkung der Proteinkomplexe und ihrer Interaktionspartner ableitet, ist nur in den wenigsten Fällen verstanden.
Der SFB wird dieses Problem mittels konvergenter, multidisziplinärer Ansätze untersuchen. Dazu zählen fortgeschrittene höchstauflösende Bildtechniken, um die Organisation membranassoziierter Gerüsten zu visualisieren, strukturbiologische und proteomische Verfahren, um molekulare Einsichten in den Aufbau von Proteinen und Proteinkomplexen zu erhalten sowie potente genetische und zellbiologische Methoden, um die Funktion ausgewählter Komponenten der untersuchten Proteingerüste in zellulären Systemen und in vivo zu studieren und zu manipulieren. Solche experimentellen Ansätze sollen mit theoretischen Methoden gepaart werden, um die zugrunde liegenden Prinzipien herauszuarbeiten, wie Gerüstproteine zelluläre Membranen auskleiden und wie diese Prozesse in Raum und Zeit reguliert werden.
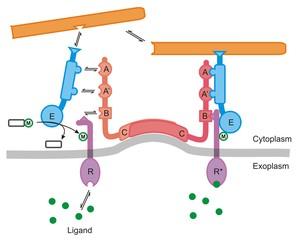
Abbildung 1: Einrüstung von Membranen. Die Einrüstung von Membranen wird oft dadurch hervorgebracht, dass sich gewöhnlich periphere Multidomänen (A-C)-Membranproteine (rot) dynamisch zu Komplexen zusammenfinden, die dann Adaptorproteine oder Enzyme (blau, E) rekrutieren. Die sich bildenden Komplexe verknüpfen Membrandynamik und zelluläre Signalverarbeitung beispielsweise durch kovalente Modifikation (M) von transmembranären Rezeptoren (violett, R). Solche dynamischen Proteinkomplexe werden oft dadurch stabilisiert, dass sich weitere protein-basierte Polymere oder Proteinhüllen (coats, orange) anlagern, die dann eine Multi-Komponentenmatrix bilden, welche die darunter gelagerte Membrandomäne zeitlich und räumlich organisiert.




